Podejrzewasz włóknienie płuc (PF)?
Nie czekaj – już dziś skieruj pacjenta do specjalistycznego ośrodka leczenia śródmiąższowej choroby płuc (ILD)

Wyniszczająca, zmieniająca życie i potencjalnie śmiertelna choroba
PF jest poważną chorobą płuc, która może prowadzić do ich nieodwracalnego uszkodzenia.1 Jest to choroba potencjalnie zagrażająca życiu i na dzień dzisiejszy - nieuleczalna.2
PF występuje u około 400 000 osób w Europie.3
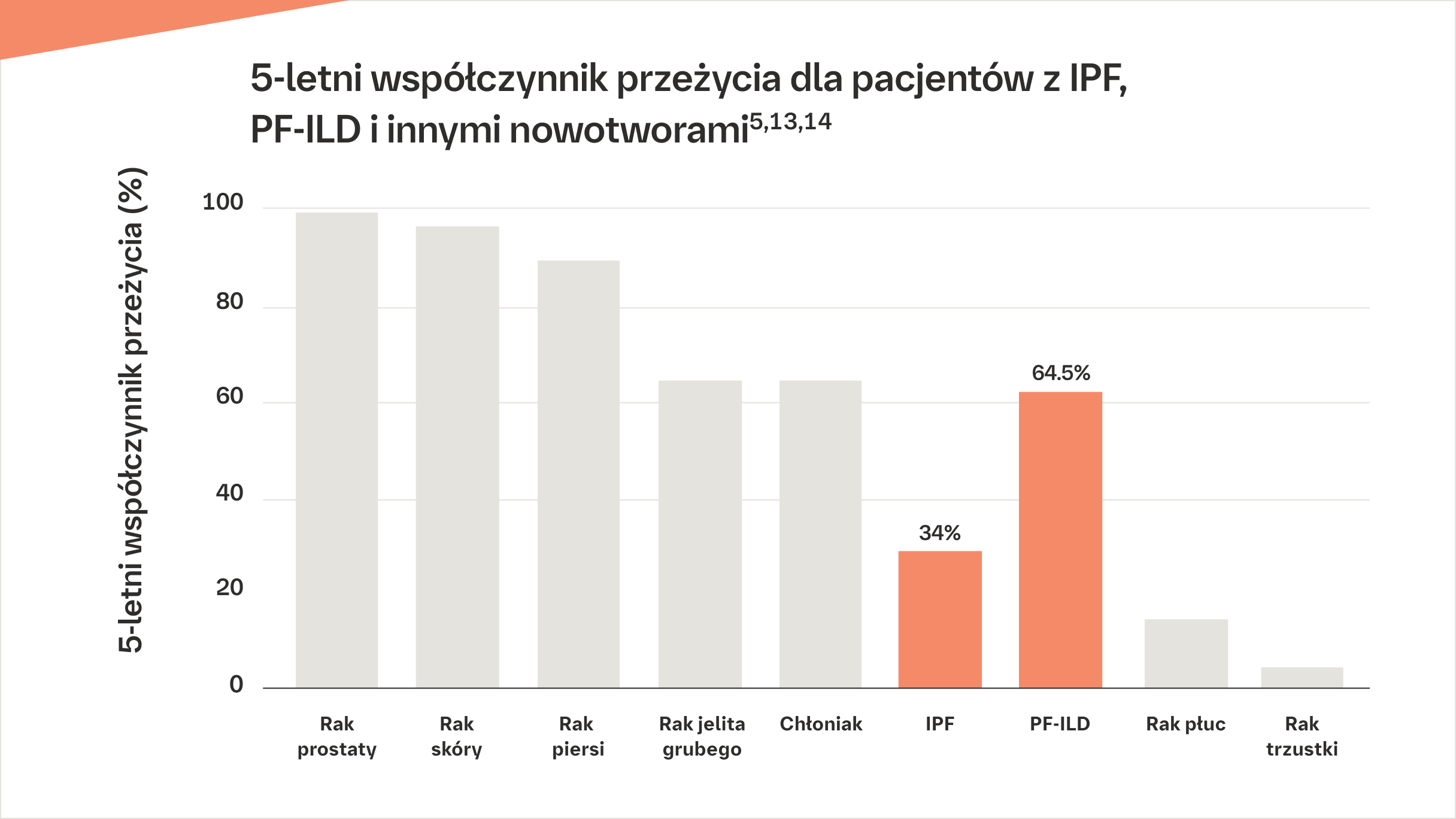
Średni czas przeżycia po rozpoznaniu PF to tylko 3–7 lat.3 Idiopatyczne włóknienie płuc (IPF) – najczęstsza włókniejąca postać ILD1 – ma jeszcze gorsze rokowanie: przeżycie wynosi zaledwie 2–5 lat4, a śmiertelność przewyższa niektóre nowotwory5. Postępujące włóknienie płuc (PF-ILD) obejmuje każdą postępującą, niewynikającą z IPF, włókniejącą ILD. 6
PF niesie ze sobą konsekwencje krótko- i długoterminowe7,8, w tym ryzyko rozwoju innych poważnych schorzeń, takich jak niewydolność serca i nadciśnienie płucne.8,9
Wczesne rozpoznanie jest kluczowe. Uszkodzenie płuc może być nieodwracalne. Często dochodzi też do błędnej lub opóźnionej diagnozy.4,10,11
Nawet u 55% pacjentów z ILD choroba ta nie jest prawidłowo rozpoznawana.12
Potencjalnie możliwe do uniknięcia konsekwencje PF
W przebiegu PF długotrwały stan zapalny w płucach może prowadzić do bliznowacenia i sztywności płuc.1,15 Ta postępująca choroba jest nieprzewidywalna i bezlitosna – z czasem upośledza funkcję płuc.1,8,16
Dlaczego szybka reakcja jest kluczowa? Wczesne rozpoznanie, skierowanie do specjalisty ILD i wdrożenie skutecznego leczenia pozwalają zachować sprawność płuc i spowolnić progresję choroby.4,10,11,17,18
Bez wdrożenia tych działań PF ma poważne krótko- i długoterminowe konsekwencje dla pacjentów:7,8
Krótkoterminowe skutki7,8,11,19,20
Brak skutecznej wymiany tlenowej
Pogarszanie się czynności płuc

Spadek saturacji i tolerancji wysiłku
Długoterminowe skutki8,9,11
Niewydolność serca
Nadciśnienie płucne

Redukcja FVC o 5–10% = wzrost ryzyka zgonu
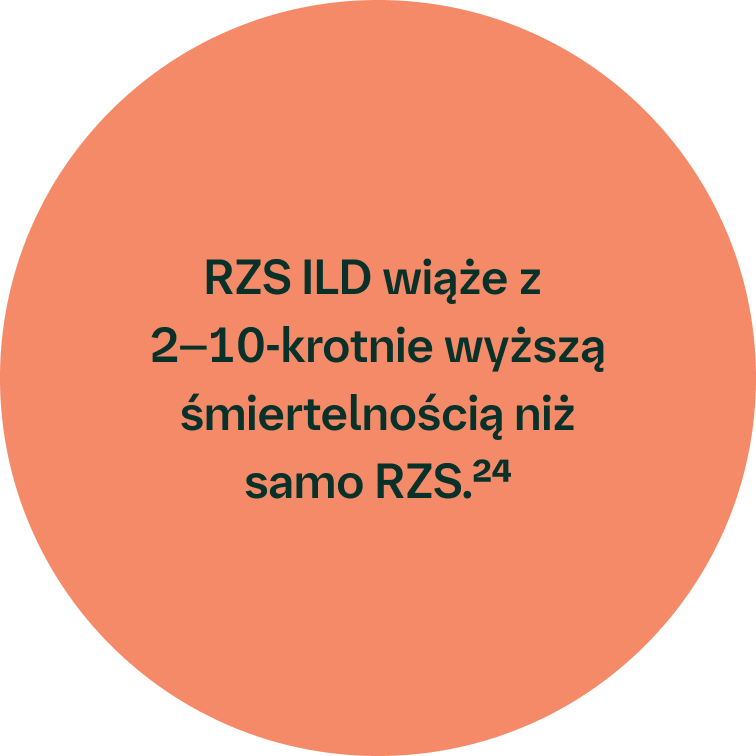
ILD często rozwijają się u osób z chorobami układowymi tkanki łącznej (CTD)
ILD może rozwinąć się u pacjentów z CTD (chorobami układowymi tkanki łącznej), takimi jak reumatoidalne zapalenie stawów (RZS) czy twardzina układowa (SSc).21
Pacjenci z CTD są narażeni na postępujące zwłóknienie płuc, niezależnie od choroby podstawowej.22
CTD-ILD stanowią poważne zagrożenie dla zdrowia pacjenta

|
|
PF: nie przegap sygnałów ostrzegawczych –poznaj czynniki ryzyka
IPF

IPF występuje u 1 na 200 osób w wieku powyżej 70 lat

Częste wśród pacjentów z IPF

Nawet u 20% pacjentów PF występuje w wywiadzie rodzinnym

Kontakt z węglem, krzemionką i azbestem zwiększa ryzyko
CTD-ILD

Reumatoidalne zapalenie stawów (RZS), twardzina układowa (SSc), idiopatyczne miopatie zapalne (IIM),mieszana choroba tkanki łącznej (MCTD) oraz zespół Sjögrena (SjD) wiążą się ze zwiększonym ryzykiem rozwoju postępującej śródmiąższowej choroby płuc (ILD) w porównaniu z populacją ogólną.

CTD-ILD częściej występuje u starszych mężczyzn

Palenie tytoniu jest istotnym czynnikiem ryzykaw przebiegu RZS
Objawy PF – na co zwrócić uwagę?
Rozpoznanie pacjentów z ostrzegawczymi objawami przedmiotowymi i podmiotowymi typowymi dla PF jest kluczowe.
Zaleca się wykonanie badań przesiewowych u pacjentów z CTD jeszcze przed wystąpieniem objawów.31 Niewyjaśnione symptomy, takie jak duszność czy suchy kaszel, powinny wzbudzić podejrzenie ILD.32-34
Najważniejsze objawy, na które należy zwrócić uwagę:10,119,35,36

Duszność i uczucie zmęczenia

Suchy, przewlekły kaszel

Palce pałeczkowate
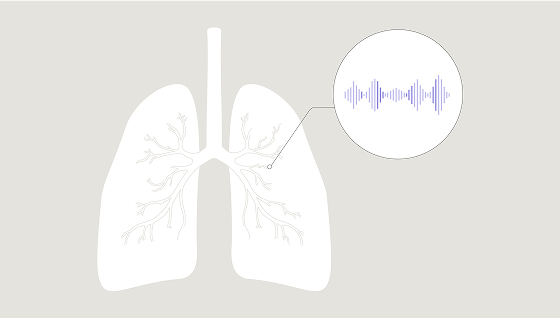
Trzeszczenia typu „taśmy rzepowej” w badaniu osłuchowym
Uwaga – zobacz jak Twoi pacjenci mogą opisywać PF!
Rozmowa z pacjentami o objawach ze strony układu oddechowego pomaga wykryć wczesne sygnały PF i umożliwia szybką interwencję.

Czas na badania przesiewowe i ocenę
Szybka ocena pacjentów z ostrzegawczymi objawami PF jest kluczowa – oto jak rozpoznać zmiany, które mogą wskazywać na włóknienie płuc:
IPF

Pozwala wykryć obustronne drobne trzeszczenia (przypominające odgłos taśmy rzepowej), słyszalne w środkowej i późnej fazie wdechu - charakterystyczne dla włóknienia płuc, w tym CTD-ILD.

Niska zdolność dyfuzyjna to często pierwszy sygnał ILD. Zmniejszona natężona pojemność życiowa i całkowita pojemność płuc mogą wskazywać na zaawansowane zwłóknienie.
Szybka, nieinwazyjna metoda. Linie B mogą sugerować PF w miejscach pogrubienia lub bliznowacenia tkanki płucnej.

Złoty standard diagnostyki PF – pozwala ocenić całe płuca, nawet gdy RTG jest prawidłowe. Badanie zazwyczaj wykonuje się w specjalistycznych ośrodkach ILD – skieruj tam pacjenta niezwłocznie. HRCT jest preferowana i rekomendowana względem samej oceny objawów i PFT.
Posłuchaj charakterystycznych zjawisk osłuchowych w przebiegu PF!
Porównaj badania osłuchowe:
Sprawdź, gdzie skierować pacjenta z podejrzeniem ILD
Wczesne skierowanie pacjenta do ośrodka ILD oraz zaangażowanie zespołu multidyscyplinarnego są kluczowe dla trafnej diagnozy i szybkiego wdrożenia leczenia. 7,10,41 Ośrodki te dysponują najnowocześniejszymi narzędziami diagnostycznymi i umożliwiają rozpoczęcie skutecznej terapii, która spowalnia progresję choroby i pomaga zachować funkcję płuc. 7,10,36 Znajdź najbliższy ośrodek, korzystając z poniższego narzędzia.
Znaleziono szpitali
Poznaj różne profile pacjentów
Skorzystaj z naszych profili pacjentów, aby szybko zidentyfikować osoby z grupy ryzyka.
Profile te pokazują kluczowe różnice w objawach, przebiegu choroby i czynnikach ryzyka, co ułatwia skuteczne rozpoznanie i reakcję na PF.
Sprawdź teraz, aby udoskonalić swoją czujność diagnostyczną!

Danuta choruje na IPF

Andrzej choruje na IPF

Jolanta choruje na RZS‑ILD

Robert choruje na przewlekłe alergiczne zapalenie pęcherzyków płucnych (pAZPP)

Agnieszka choruje na SSc‑ILD
-
Yu QY, Tang XX. Aging Dis. 2022;13(1):73–86.
-
Caban JJ, et al. Conf Proc IEEE Eng Med Biol Soc. 2011;2011:6216–6219.
-
European Pulmonary Fibrosis Federation. https://www.eu-pff.org/about-pulmonary-fibrosis/ Accessed July 2025.
-
Molina-Molina M, et al. Expert Rev Respir Med. 2018;12(7):537–539.
-
Vancheri C, et al. Eur Respir J. 2010;35(3):496–504.
-
Raghu G, et al. Am J Respir Crit Care Med. 2022;205(9):e18–e47.
-
Hofman DE, et al. Respir Res. 2024;25(1):395.
-
Pulmonary Fibrosis Foundation. Available at:https://www.pulmonaryfibrosis.org/understanding-pff/about-pulmonary-fibrosis/what-is-pulmonary-fibrosis. Accessed July 2025.
-
Panagiotou M, et al. Eur Respir Rev. 2017;26:160053.
-
Oldham JM, Noth I. Respir Med. 2014;108(6):819–29.
-
Cosgrove GP, et al. BMC Pulm Med. 2018;18(1):9.
-
Arcana RI, et al. J Pers Med. 2023;13:1589.
-
Strongman H, et al. Adv Ther. 2018;35(5):724–736.
-
Kwon BS, et al. Respir Res. 2021;22:282.
-
Chimenti I, et al. Front Physiol. 2022;21;12:830683.
-
Wells AU, et al. Respir Res. 2024;25:448.
-
Alsomali H, et al. Pulm Ther. 2023;9(2):177–193.
-
Hoyer N, et al. BMJ Open Respir Res. 2022;9(1):e001276.
-
Pulmonary Fibrosis Foundation. Available at: https://www.pulmonaryfibrosis.org/understanding-pff/about-pulmonary-fibrosis/symptoms. Accessed July 2025.
-
Nho RS, et al. Am J Pathol. 2022;192(5):750–761
-
Johnson SR, et al. Arthritis Rheumatol. 2024;76:1201–13.
-
Castelino FV, Moua T. ACR Open Rheumatol. 2021;3(5):295–304.
-
Molina-Molina M, et al. Expert Rev Respir Med. 2022;16(7):765–774.
-
Juge P-A, et al. RMD Open. 2023;9:e003491.
-
Pulmonary Fibrosis Foundation. Available at: https://www.pulmonaryfibrosis.org/docs/default-source/programs/educational-materials/pulmonary-fibrosis-quick-facts/about-pf-fact-sheet---march-2021.pdf?sfvrsn=8742afc_10. Accessed July 2025.
-
Pulmonary Fibrosis Foundation. Available at: https://www.pulmonaryfibrosis.org/understanding-pff/about-pulmonary-fibrosis/causes. Accessed July 2025.
-
Zaman T, Lee JS. Curr Pulmonol Rep. 2018;7(4):118–125.
-
Raghu G, et al. Am J Respir Crit Care Med. 2018;198(5):e44–e68.
-
Joy GM, et al. Eur Respir Rev. 2023;32:220210.
-
Shaw M, et al. Eur Respir Rev. 2015;24(135):1–16.
-
Morais A, et al. Pulmonology. 2025;31(1):2416840.
-
Esposito AJ, et al. Clin Chest Med. 2019;40(3):545–560.
-
Brady D, et al. Radiol Cardiothorac Imaging. 2021;3(4):e200625.
-
Wallace B, et al. Curr Opin Rheumatol. 2016;28(3):23–45.
-
Sgalla G, et al. BMC Pulm Med. 2018;18(1):103.
-
Kumar DP. Indian J Rheumatol. 2021;16(Suppl 1):S69–S78.
-
Shao T, et al. Front Immunol. 2021;12:684699.
-
Pulmonary Fibrosis Foundation. https://www.pulmonaryfibrosis.org/docs/default-source/programs/educational-materials/ptfspulmonaryfunction-tests/pff_-pulmonary-function_v10_final-version-1.pdf?sfvrsn=33a8e250_1. Accessed July 2025.
-
Manolescu D, et al. Clin Interv Aging. 2018;13:437–449.
-
Watanabe S, et al. Mod Rheumatol. 2025;35:79–87.
-
Lough G, et al. ERJ Open Res. 2025;11(2):00899–2024.

